
1. 실험 목적
화학진동반응의 원리를 이해하고 시간이 지남에 따라 용액의 색이 변하는 이유를 학습하면서 브릭스 라우셔 반응의 원리를 설명할 수 있다.
2. 실험 원리
(A) 원자 : 물질을 이루고 있는 기본 입자로 원자핵과 전자로 구성. 원자핵과 전자는 서로 다른 전하를 띠고 전하량이 동일하기 때문에 전기적으로 중성을 띰.
(B) 이온 : 전기적으로 중성인 원자나 원자단이 전자를 잃거나 얻게 되면서 전하를 띠는 입자. (+)전하를 띠는 입자는 양이온. (-)전하를 띠는 입자는 음이온.
(C) 아이오딘 : 53I. 표준 온도와 압력에서 보라색을 띠는 고체. 용매나 아이오딘의 입자 상태에 따라 용액의 색이 달라지는 것을 이용하여 이번 실험에서는 아이오딘산 칼륨에 들어있는 아이오딘화 이온이 화학반응에 의해 다음 과정과 같이 용액의 색이 변하는 것을 확인할 수 있음.
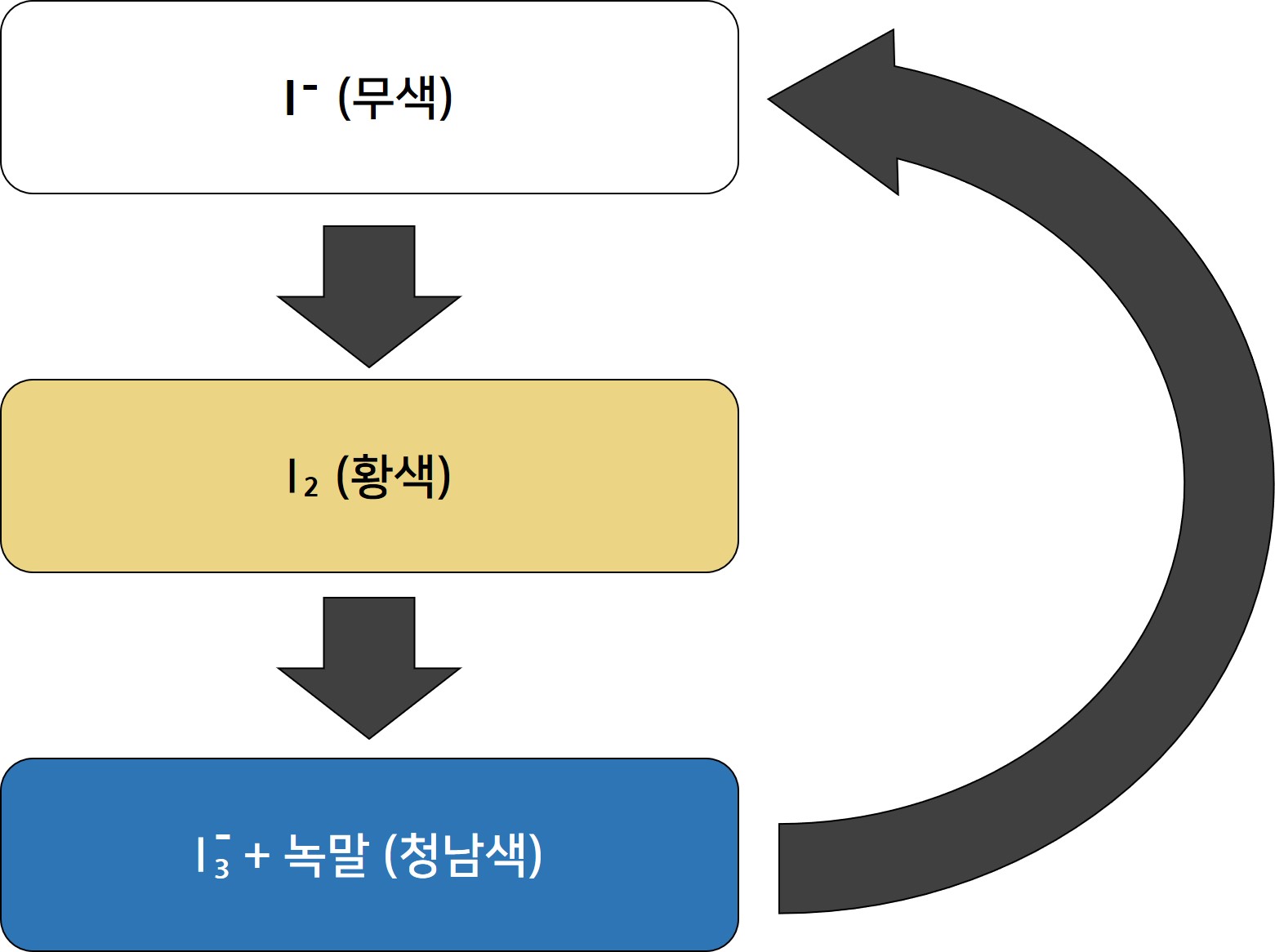
(D) 아이오딘-녹말 반응 : 녹말과 삼아이오딘화 이온의 반응으로 인해 아이오딘-녹말 착물을 형성하면서 청남색을 띰. 이 때문에 녹말 검출에 이용됨. 아이오딘이 삼아이오딘화 이온의 형태로 베타-아밀로오스의 코일 속에 들어가 녹말과 전하 이동하면서 청남색을 띠는 것으로 알려져있음.
(E) 화학 진동 반응 : 화학 반응이 진행되면서 반응 중간체의 농도가 일정하게 유지되는 것이 아니고 진동을 반복하면서 나타나는 현상을 표시하는 반응.
(F) 브릭스 라우셔 반응 : 1972년 고등학교 교사인 브릭스와 라우셔가 발견한 반응으로 당시에 주목받지 못했던 진동반응을 간단한 방법으로 색 변화를 통해 관찰할 수 있어 비평형 열역학 발전에 기여할 수 있었음. 비라디칼 반응과 라디칼 반응으로 구성.
(1) 비라디칼 반응 : 아이오딘화 이온의 중간 생성 단계를 포함. 말론산에 의해 소비되는 아이오딘화 이온의 반응 속도가 느린 단계임.
(2) 라디칼 반응 :열, 자외선 조사 등에 의해 생성되는 작용기가 반응 중간체로 관여하는 반응으로, 보통 대부분의 라디칼 반응은 다단계 반응임. 이번 실험에서는 과산화수소와 아이오딘화 이온이 아이오딘과 산소로 바뀌는 과정임. 비라디칼 반응과 다르게 일정 속도에 다다를 때까지는 빠르게 진행됨.
① 아이오딘화 이온이 과산화 수소로 인해 아이오딘으로 변하면서 용액의 색은 무색에서 황색으로 변함.
2IO3- + 2H+ + 5H2O2 → I2 + 5O2 + 6H2O
② 아이오딘은 말론산과 반응하여 아이오딘화 이온을 만들어내면서 용액의 색은 황색에서 무색으로 변함.
I2 + C3H4O4 → C3H3O4I + I- + H+
③ 아이오딘은 아이오딘화 이온과 빠르게 결합하면서 삼아이오딘화 이온을 형성하게 됨.
I2 + I- → I3-
④ 이렇게 형성한 삼아이오딘화 이온은 녹말과 결합하여 청남색을 띠는 착물을 형성함.
I3- + starch → Dark blue complex
⑤ 삼아이오딘화 이온이 여러과정을 거치고 다시 아이오딘 이온과 아이오딘으로 분리되면서 청남색에서 황색을 띰.
Dark blue complex → I2 + I-
⑥ 이러한 반응이 반복되면서 용액의 색이 무색 → 황색 → 청남색 → 무색 → ... 으로 반복적으로 관찰됨.
HIO3 + 2H2O2 + C3H4O4 → C3H3O4I + 2O2 + 3H2O
화학반응 도중, 비라디칼 반응이 라디칼 반응보다 더 빠르게 일어나는 지점이 존재하게 되는데, 이 지점에서 아이오딘의 농도가 점점 낮아진다. 낮아진 아이오딘의 농도로 인해서 라디칼 반응을 통해 아이오딘 생성이 다시 시작될 수 있게 되면서 이전의 사이클을 반복하게 된다. 즉, 라디칼 반응이 발생하면서 아이오딘 생성으로 인해 용액의 색이 무색에서 점점 황색으로 변하다가 라디칼 반응이 잠시 멈추게 되면서 생성된 아이오딘이 녹말과 반응하여 용액의 색이 청남색으로 변하게 된다. 하지만 이 과정에서 비라디칼 반응이 일어나게 되면 착물이 분리되고 그로인해 용액의 색이 청남색을 점점 잃게 된다. 그리고 다시 라디칼 반응으로 다시 순환되면서 이 과정이 반복된다.
3. 실험 과정
(1) 실험 기구 : 자석교반기, 마그네틱바, 전자저울, 매스실린더, 250 mL 비커, 100 mL 비커, 약포지, 약숟가락, 유리막대
(2) 실험 시약 : 아이오딘산 칼륨, 95% 황산, 30% 과산화수소, 말론산, 수용성 녹말, 황산망간1수화물, 티오황산나트륨, 증류수
실험 A. 화학진동반응 확인하기
1. 50 mL 증류수에 30% 과산화수소를 20 mL를 첨가한 후 잘 섞어주어, 용액 A를 제조한다.
2. 20 mL 증류수에 0.3 g의 황산망간1수화물과 0.55 g의 말론산을 넣어 잘 섞어주어, 용액 B를 제조한다.
3. 10 mL 증류수에 0.35 g의 수용성 녹말을 녹인 용액을 용액 B와 함께 섞어준다.
4. 100 mL 증류수에 4.3 g의 아이오딘산 칼륨, 0.5 mL의 황산 용액을 첨가한 후 잘 섞어주어, 용액 C를 제조한다.
5. 100 mL 비커를 자석 교반기 위에 둔 다음, 마그네틱바를 넣는다.
6. 제조한 용액 A 20 mL를 첨가한 후, 자석 교반기를 가동한다.
7. 이후, 용액 B 20 mL와 용액 C 20 mL를 순차적으로 첨가한다. 이때, 반드시 용액 A와 용액B를 섞어준 후에 용액 C를 첨가하도록 한다.
8. 용액 A, B, C를 순차적으로 첨가했을 때의 색변화와 시간이 지남에 따라 바뀌는 색변화를 관찰하고 실험 노트에 작성한다.
9. 자석 교반기의 속도를 다르게 하면 실험에 어떤 변화를 주는지 관찰하고 실험노트에 작성한다.
10. 실험이 끝난 후 아이오딘 기체가 나온다면 폐기를 위해서 반응이 끝날 수 있도록 꼭 티오황산나트륨을 첨가하도록 한다.
▶ 다른 실험 보러가기
'화학 > 고등학교 실험' 카테고리의 다른 글
| [고등학교 실험] 은나무 만들기 실험 (1) | 2021.02.06 |
|---|---|
| [고등학교 실험] 살리실산메틸 합성 실험 보고서(2) (2) | 2021.01.14 |
| [고등학교 실험] 살리실산메틸 합성 실험 보고서(1) (1) | 2021.01.14 |
| [고등학교 실험] 전해질 용액의 성질/전기 분해 실험 보고서(2) (1) | 2021.01.14 |
| [고등학교 실험] 전해질 용액의 성질/전기 분해 실험 보고서(1) (1) | 2021.01.13 |




댓글